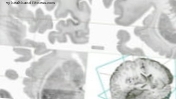
Torsdag den 24. oktober 2013.- Forskere ved University of Massachusetts School of Medicine, i USA (UMMS), har vist, at annullering af et vigtigt gen til oversættelse af messenger RNA (mRNA) i neuroner genopretter underskuddet af hukommelse og reducerer adfærdssymptomer i en musemodel af skrøbeligt X-syndrom.
Disse resultater, der er offentliggjort i 'Naturmedicin', antyder, at den vigtigste årsag til denne udbredte menneskelige neurologiske sygdom kan være en translationel ubalance, der resulterer i høj proteinproduktion i hjernen. Gendannelse af denne balance kan være nødvendig for normal neurologisk funktion.
Biologi fungerer underligt, '' sagde Joel Richter, professor i molekylær medicin ved UMMS og hovedforfatter af undersøgelsen. Vi har korrigeret en genetisk mutation med en anden, som viste, at to fejl gør en succes. Vi fandt, at mutationer i begge gener resulterer i normal hjernefunktion. Dette lyder i modsætning til intuition, men i dette tilfælde synes det at være, hvad der skete. "
Fragilt X-syndrom, den mest almindelige form for nedarvet mental retardering, er en genetisk tilstand, der skyldes en gentagen ekspansion af CGG i den skrøbelige X-gen (FMR1) DNA-sekvens, der kræves til normal neurologisk udvikling. Mennesker med skrøbelige X lider af intellektuel handicap og adfærds- og læringsproblemer, og afhængigt af længden af CGG-gentagelsen kan intellektuel handicap variere fra mild til alvorlig.
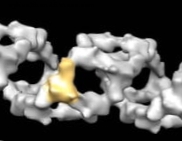
Selvom forskere har identificeret den genetiske mutation, der forårsager Fragile X-syndrom, ved de på molekylært niveau stadig ikke meget om, hvordan sygdommen fungerer, eller hvad der går galt i hjernen. Hvad der er kendt er, at FMR1-genet koder for det skrøbelige X-kromosomprotein (FMRP).
I årevis studerede Richter, hvordan translation, processen, hvor cellulære ribosomer skaber proteiner, gik fra inaktiv til aktiv i frøæg og opdagede nøglenet, der kontrollerer denne proces, det RNA-bindende CPEB-protein. I 1998 så han, at CPEB i gnaverhjernen spiller en vigtig rolle i reguleringen af, hvordan synapser kommunikerer.
Ved at annullere FMRP og CPEB var vi i stand til at gendanne proteinsynteseniveauet til normale og korrigere sygdomskarakteristika hos skrøbelige X-mus, så de næsten ikke kunne skelnes fra mus af vildtype, ”sagde han.
"Mennesker med skrøbelige X producerer for meget protein, " sagde Richter. "Ved at bruge CPEB kan du kalibrere det cellulære maskineri, der får proteinerne, som vi har vist, til at tæmme denne proces, har stor indflydelse på musemodeller. med skrøbelige X. Det er muligt, at en lignende tilgang kan være fordelagtig for børn med denne sygdom, ”opsummerede han.
Kilde:
Tags:
Wellness Seksualitet Nyheder
Disse resultater, der er offentliggjort i 'Naturmedicin', antyder, at den vigtigste årsag til denne udbredte menneskelige neurologiske sygdom kan være en translationel ubalance, der resulterer i høj proteinproduktion i hjernen. Gendannelse af denne balance kan være nødvendig for normal neurologisk funktion.
Biologi fungerer underligt, '' sagde Joel Richter, professor i molekylær medicin ved UMMS og hovedforfatter af undersøgelsen. Vi har korrigeret en genetisk mutation med en anden, som viste, at to fejl gør en succes. Vi fandt, at mutationer i begge gener resulterer i normal hjernefunktion. Dette lyder i modsætning til intuition, men i dette tilfælde synes det at være, hvad der skete. "
Fragilt X-syndrom, den mest almindelige form for nedarvet mental retardering, er en genetisk tilstand, der skyldes en gentagen ekspansion af CGG i den skrøbelige X-gen (FMR1) DNA-sekvens, der kræves til normal neurologisk udvikling. Mennesker med skrøbelige X lider af intellektuel handicap og adfærds- og læringsproblemer, og afhængigt af længden af CGG-gentagelsen kan intellektuel handicap variere fra mild til alvorlig.
Selvom forskere har identificeret den genetiske mutation, der forårsager Fragile X-syndrom, ved de på molekylært niveau stadig ikke meget om, hvordan sygdommen fungerer, eller hvad der går galt i hjernen. Hvad der er kendt er, at FMR1-genet koder for det skrøbelige X-kromosomprotein (FMRP).
I årevis studerede Richter, hvordan translation, processen, hvor cellulære ribosomer skaber proteiner, gik fra inaktiv til aktiv i frøæg og opdagede nøglenet, der kontrollerer denne proces, det RNA-bindende CPEB-protein. I 1998 så han, at CPEB i gnaverhjernen spiller en vigtig rolle i reguleringen af, hvordan synapser kommunikerer.
Ved at annullere FMRP og CPEB var vi i stand til at gendanne proteinsynteseniveauet til normale og korrigere sygdomskarakteristika hos skrøbelige X-mus, så de næsten ikke kunne skelnes fra mus af vildtype, ”sagde han.
"Mennesker med skrøbelige X producerer for meget protein, " sagde Richter. "Ved at bruge CPEB kan du kalibrere det cellulære maskineri, der får proteinerne, som vi har vist, til at tæmme denne proces, har stor indflydelse på musemodeller. med skrøbelige X. Det er muligt, at en lignende tilgang kan være fordelagtig for børn med denne sygdom, ”opsummerede han.
Kilde: